‘Although there’s no evidence at all of a link between caffeine and cancer, we’re putting two and two together and saying: caffeine can induce these changes and it has been shown that these changes are elevated in leukaemia patients,’ added Dr Cooke.Er leitet sich also aus dem Fehlen eines Beweises die Grundlage seiner Forschung und gleich auch noch das passende Ergebnis ab? Ich ruf da mal gleich beim Nobelpreiskomitee an...
Worauf die bloggenden Kollegen (mit Ausnahme von Neuroskeptic) in ihrer Aufregung aber gar nicht eingegangen sind, und Herr Cooke wohl "übersehen" hat: Die Verbindung Koffein und Genomstabilität ist bereits recht gut verstanden! Leider aber nicht so, wie es in dem Artikel dargestellt wird. Aber der Reihe nach.
Signalisierung von Schäden an der DNA
Ich bin in ein paar Posts schon auf die Reparatur von DNA-Schäden eingegangen, aber einen wichtigen Teil davon habe ich bisher unterschlagen. Denn bevor die Zelle wirklich die Schäden repariert, muss sie erst noch entscheiden, ob sich die Reparatur überhaupt lohnt. Denn bei zahlreichen Schäden besteht immer auch die Gefahr, dass sich Mutationen einschleichen. Und bevor sich dann Krebs entwickelt, opfert der Organismus lieber eine Zelle. Dieser programmierte Zelltod folgt einem strengen genetischen Programm und wird als Apoptose bezeichnet. Hat sich die Zelle entschieden, die Schäden doch zu reparieren, dann müssen zunächst die zahlreichen Reparaturproteine aktiviert werden. Außerdem sollte während der Reparatur der Zellzyklus angehalten werden. Es wäre nämlich sehr schlecht, wenn die Zelle mitten im Reparaturprozess anfängt, ihre DNA zu replizieren, oder sich zu teilen.
ATM und ATR
Eine zentrale Rolle bei all diesen Signalen spielen zwei verwandte Proteine, die beim Menschen ATM und ATR heißen. Beide sind Kinasen, also Enzyme, die die Aktivität anderer Proteine regulieren, indem sie Phosphatgruppen auf bestimmte Aminosäuren übertragen. Im Fall von ATM und ATR ist diese Kinaseaktivität nun abhängig von verschiedenen Schäden an der DNA: Dadurch werden sie aktiviert, und übertragen Phosphate auf Proteine, die die oben angesprochenen Prozesse wie Apoptose, Zellzyklus oder Reparatur regulieren. Fallen ATM und ATR aus, führt dies beim Menschen zu Erbkrankheiten wie Ataxia-telangiectasia (ATM, versucht mal das mehrmals hintereinander zu sagen) oder Seckel Syndrom (ATR). Eigentlich sollte es nicht überraschen, dass Menschen, die an Ataxia-telangiectasia leiden, sehr strahlenempfindlich sind. Ionisierende Strahlung erzeugt schließlich DNA-Schäden, und durch den Ausfall von ATM funktioniert dann die Regulation von Reparatur etc. nicht mehr. Dieser Punkt ist aber noch aus einem anderen Grund wichtig, wie wir gleich sehen werden.

Abbildung des ATM-Signalweges in der Zelle aus dem GeneAssistTM Pathway Atlas von Ambion/Applied Biosystems. Gezeigt sind die wichtigsten Prozesse, die von ATM reguliert werden. Zielprotein werden von ATM aktiviert durch Anheften von Phosphatgruppen, dargestellt durch die Kreise mit "P" an den Proteinen.
Koffein hemmt ATM und ATR
Vor ein paar Jahren machten dann ein paar Forschergruppen eine interessante Entdeckung: Die Aktivität von ATM (und ATR) kann gehemmt werden durch Gabe von Koffein. Die Gruppe von Zhou et al. hat Glück, ihr im Journal of Biological Chemistry veröffentlichter Artikel darf für Lehrzwecke auch online frei benutzt werden. Durch Arbeiten mit Zellkulturen konnten sie zeigen, dass durch die Zugabe von Koffein mehrere von ATM aktivierte Signalketten unterdrückt wurden, beispielsweise ein Stopsignal im Zellzyklus, das die Einleitung der Zellteilung bei DNA-Schäden verhindern soll (der G2/M-Checkpoint). Dieser Effekt ahmt das Verhalten von A-T Zellen (Zellen von Patienten, die an Ataxia-telangiectasia leiden und in denen ATM inaktiv ist) nach, wie in Abbildung 5 des Artikels schön zu sehen ist.
Chk2 ist ebenfalls eine Kinase, die aber hauptsächlich den Reparaturweg reguliert und von ATM aktiviert werden muss. Ohne jetzt groß das Prinzip hinter elektrophoretischen Methoden erklären zu wollen, sieht man nach Bestrahlung der Zellen die Aktivierung von Chk2 durch ATM in der höheren Bande bei 2 (vgl. mit 1), weil das Chk2-Molekül durch Anheften einer Phosphatgrupppe größer geworden ist. Diese Aktivierung findet nach Behandlung mit Koffein nicht mehr statt (die Bande ist bei 4 auf der gleichen Höhe wie die inaktive Kontrolle bei 1, es wurde also keine Phosphatgruppe drangehängt). Dieses Ergebnis ist vergleichbar mit dem Verhalten von A-T Zellen ohne Koffeinbehandlung (Nummern 5/6).
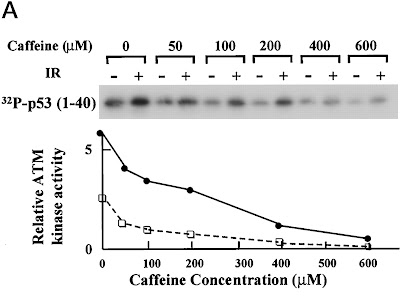
In Abbildung 7 haben Zhou und Kollegen einen weiteren von ATM regulierten Weg angesehen, die Apoptose. Sehr wichtig zum Einleiten der Apoptose (dem programmierten Zelltod) ist das Protein p53, das ebenfalls durch Anheften einer Phosphatgruppe von ATM aktiviert werden kann. Wie man hier sehr schön sehen kann, wird p53 mit steigender Koffeinkonzentration immer weniger aktiviert, und das sogar ohne Bestrahlung (ausgeüllte Kreise: +Bestrahlung, offene Quadrate: -Bestrahlung)! Dies bedeutet, dass auch in wenigen Zellen, deren DNA nicht durch Bestrahlung massiv geschädigt wurde, spontane Schäden auftreten, die in einer Aktivierung von p53 (und wohl dem Auslösen der Apoptose) resultieren. Und Koffein kann das durch Hemmung von ATM unterdrücken.
Die medizinische Anwendung
Weiter oben habe ich bei der Beschreibung der Krankheit Ataxia-telangiectasia gesagt, dass die Patienten sehr strahlensensitiv sind, und die Daten hier haben auch gezeigt warum: ATM als zentraler Regulator von vielen zellulären Prozessen nach Schädigung der DNA kann diese Prozesse nicht mehr aktivieren, die Schäden werden nicht repariert und die Zellen versuchen munter, sich trotzdem zu teilen. Da Koffein dieses Erscheinungsbild von A-T Zellen nachahmen kann, wird es seit mehreren Jahren in der Krebsmedizin eingesetzt: Tumorzellen reagieren auf eine Strahlentherapie sensitiver, wenn der Patient zusätzlich Koffein verabreicht bekommt. Und dieser nützliche Effekt konnte auch für mehrere Chemotherapeutika gezeigt werden (etwa Cisplatin).
Nicht vergessen: die Konzentration!
Was in dem Daily Mirror-Artikel leider unterschlagen wird: Um diese Effekte von Koffein beim Menschen zu erreichen, sind Konzentrationen von etwa 10 mM nötig. Nach Trinken einer Tasse starken Kaffees liegt die Konzentration im Blut aber bei etwa 50 µM [1], sie ist also circa 200 mal niedriger. Anders ausgedrückt: Koffein ist nach maximal fünf Stunden im Blut wieder abgebaut, man müsste also mindestens 200 Tassen starken Kaffee innerhalb von weniger als fünf Stunden trinken, um einen Effekt von Koffein auf ATM zu erreichen!
Das Fazit der ganzen Geschichte: Der Daily Mirror sollte sich schämen, schwangeren Frauen Angst einzujagen, und Herr Cooke sollte vor seinem nächsten Projekt zumindest fünf Minuten recherchieren, mehr brauchts nämlich nicht. Und die Literatur ist wie gezeigt zumindest teilweise frei zugänglich.
[1] Berechnet aus einer Koffein-Plasmakonzentration von 10 mg/l und der Annahme von 8 mg/kg Koffein nach Genuss einer Tasse Kaffee.
[2] Sorry für den Titel, aber ich konnte es mir nicht verkneifen ;-)
Zhou, B. B., Chaturvedi, P., Spring, K., Scott, S. P., Johanson, R. A., Mishra, R., Mattern, M. R., Winkler, J. D., Khanna, K. K. (2000). Caffeine abolishes the mammalian G(2)/M DNA damage checkpoint by inhibiting ataxia-telangiectasia-mutated kinase activity J Biol Chem, 275 (14), 10342-10348







Keine Kommentare:
Kommentar veröffentlichen